심리검사 잘못했다가

1) 개요
-
18 세기 말 르블랑은 소금과 황산을 사용하여 탄산 나트륨(소다회)을 만드는 데 성공
-
1860년에 솔베이가 새로운 탄산 나트륨 제조 방법인 솔베이법(암모니아 소다법)을 발명
-
솔베이법은 르블랑법보다 양질의 값싼 탄산 나트륨을 제조할 수 있기때문에 급속한 발전을 하여, 현재 전세계의 탄산 나트륨 제조는 모두이 방법을 이용
2) 성질과 용도
-
탄산나트륨(sodium carbonate: Na2C03)은 흰색 의 가루로 수화물은 공기 중에서 풍화되기 쉽고 물에 잘 녹음
-
수용액은 가수 분해되어 강한 알칼리성을 나타내며, 이산화탄소를 쉽게 흡수
-
제일 많이 쓰이는 곳은 판유리 및 유리 제품의 제조 원료이며, 조미료의 제조, 비누, 제지, 염료 및 의약품 등의 제조에 사용
-
그 밖에, 향료 합성, 페인트, 도자기, 법랑, 우지의 정제, 양럴의 세척 및 직물의 염색 등에도 사용

그림 탄산 나트륨의 분자 구조 및 고제 분말
3) 탄산 나트륨의 제조
-
일반적으로 탄산 나트륨은 소금을 원료로 하여 합성하는 합성 소다회와 천연에 존재하는 탄산나트륨염을 정제하여 얻는 천연 소다회 등
-
소금을 원료로 하여 얻어지는 공업적 제법으로는 르블랑법, 암모니아 소다법(솔베이법) 및 염화암모늄 소다법 등
가) 르블량법
-
황산나트륨 을 중간 생성 물로 하여 소금을 소다회로 전환시키는 방법
-
이 방법은 제조 과정에서 유독성 폐기물이 발생하는 공해 문제 유발로 지금은사용하지 않음
나) 암모니아 소다법(솔베이법)
-
암모니아를 포화시킨 소금의 포화 수용액에 이산화탄소를 통과시켜 용해도가 작은 탄산수소나트륨(중탄산나트륨, 중조)을 침전
NaCl + NH3+ CO2+ H2O → NaHC03+ NH4Cl
-
만들어진 탄산수소나트륨을 2000℃ 정도에서 하소하여 탄산나트륨을 제조
2NaHC03 → Na2C03+ CO2 + H2O
-
부생되는 이산화탄소와 염화암모늄에서 회수한 암모니아는 순환시켜 사용
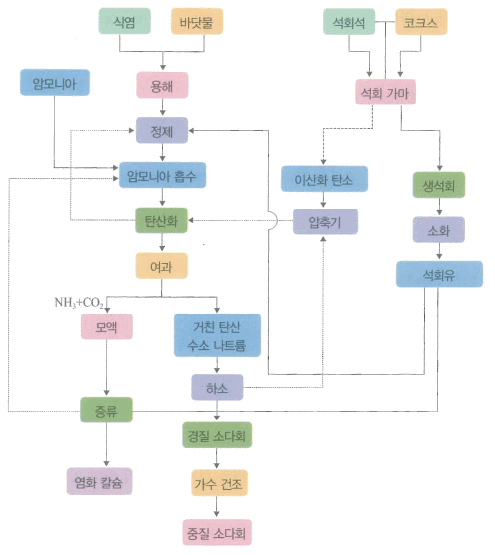
그림 암모니아 소다법에 의한 탄산 나트륨의 제조
① 소금물의 정제
-
소금을 먼저 바닷물에 녹인다. 이 때, 소금의 용해도는 온도의 영향을 거의 받지 않으므로 가열할 필요가 없다.
-
정제 공정에서는 청정 탱크를 사용하여 염화마그네슘, 칼슘염 등의 불순물을 제거해 사용
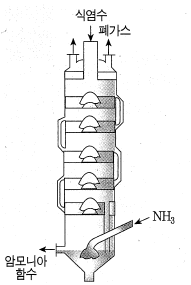
② 암모니아 소금물의 제조
-
암모니아 흡수탑의 윗부분에서 소금물을 흘려보내 밑부분에서 암모니아를 불어 넣어 암모니아 소금물을 제조
그림 암모니아 흡수탑
③ 탄산수소나트륨의 하소
④ 암모니아 소금물의 탄산화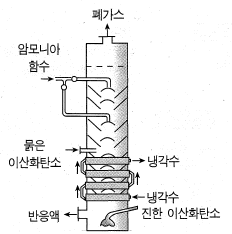
-
탄산화탑의 윗부분에서 암모니아 소금물을 넣고, 아랫 부분에서 이산화탄소를 불어 넣으면, 윗부분에서 주로 중화 공정이 일어나서 탄산수소암모늄이 생성
-
아랫부분의 침전탑에서는 탄산수소나트륨의 침전 반응
NH3 + CO2 + H2O → NH4HC03
NaCl + NH4HC03 → NaHC03+ NH4Cl
그림
탄산화탑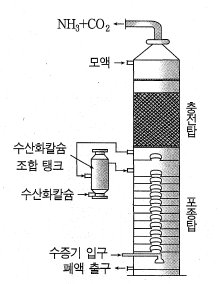
⑤ 분리한 모액으로 부터 암모니아의 회수
-
탄산 나트륨을 분리한 모액 속에는 반응하지 않은 염화 나트륨 및 탄산수소나트륨 이외에 탄산수소암모늄, 염화 암모늄 등이 들어 있으므로 이를 암모니아 증류탑으로 보내어 암모니아를 회수
NH4HC03 → NH3 + CO2 + H2O
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
다) 염화암모늄 소다법
-
암모니아 소다법을 개량 및 변형한 것으로, 원료로 사용하는 식염의 성분 중에 나트륨뿐만 아니라 염소까지 그 이용률을 높이기 위하여 개발된 것
-
이 방법에서는 탄산나트륨과 함께 부산물로 비료로 사용할 수 있는 염화암모늄을 얻을 수 있다.
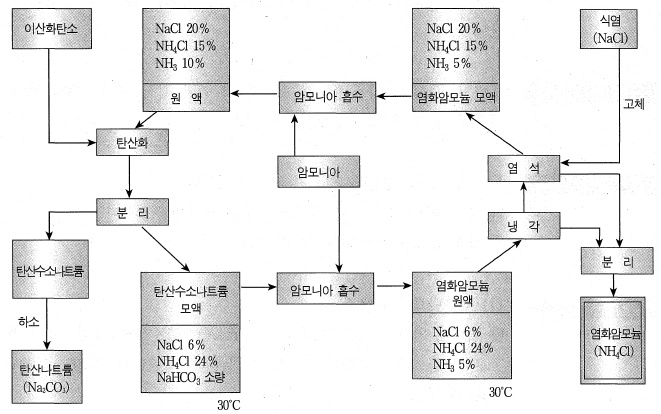
그림 염화 암모늄 소다법의 공정

REVIVAL 동기부여영상